

基因编辑技术的应用,正在我国按下加速键。
2023年4月,我国首个农业用基因编辑生物安全证书颁发,一种高油酸大豆通过安全认证;2024年5月,我国首个主粮作物基因编辑生物安全证书获批。

作为革命性的生物技术,基因编辑可根据需要,对生物基因组进行修饰改动,为农业良种选育带来了巨大的想象空间。近十年来,我国水产基因编辑研究进展加速,在十多个品种上取得重要成果。
然而,新技术也引发了对风险性的激烈讨论。
技术上,科学界关注脱靶效应、不可预测的基因组改变以及代际遗传影响等核心问题;在应用层面,特别是动物养殖和水产养殖中,生态逃逸和基因扩散等风险引起担忧。
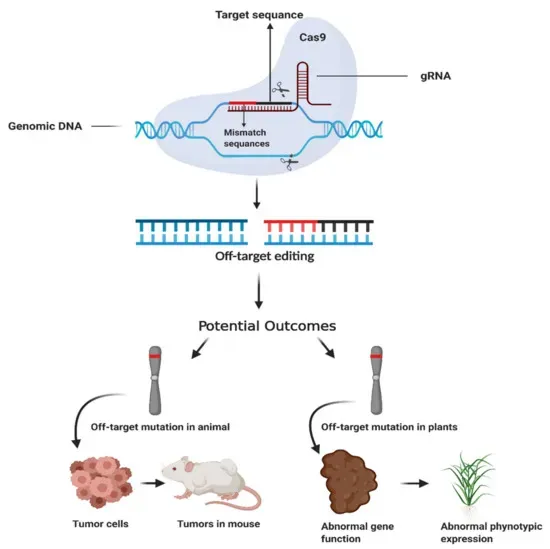
脱靶突变会影响动物和植物的表型。这些突变发生在基因编辑工具(如CRISPR/Cas9)误将gRNA绑定到目标位点以外的地方,称为脱靶位点。这可能会激活动物体内的致癌基因,导致肿瘤细胞的形成;在植物中,它可能改变基因的功能,导致不良的表型表现(如植物对疾病的敏感性)。
更重要的是,即使技术问题被逐一解决,如何获得更高的社会接受度,依然是走向市场应用必经的终极命题——而这,也成为了基因编辑的“阿喀琉斯之踵”。

现实
育种技术不断重构产业格局
当前,全球生物育种领域蓬勃发展,不断重构种业产业格局。2021年至今,中央一号文件连年强调推动生物育种发展。近年来,我国在分子标记辅助育种、全基因组选育、多倍体技术等领域取得快速进展。
基因编辑技术不仅能提升动物的生产性能和抗病能力,还能改善肉质,尤其在改良动植物品种方面展现出巨大的潜力。结合基因编辑和选择性育种技术,可以显著提升动物的生长速度和饲料转化率,从而提高农业生产效率。
具体到水产,和传统选育、杂交选育等方法比较,基因编辑技术可以对特定基因进行定向精准编辑,实现对鱼类生产性状的显著改良,突破选育性状单一、周期长、效率低、突破性新品种少等难题。
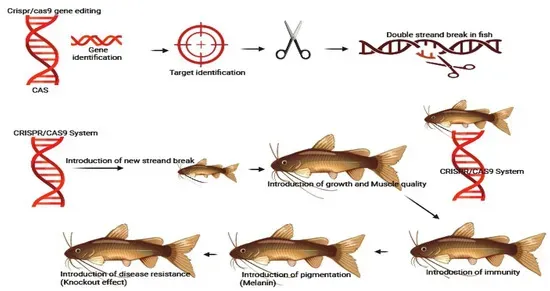
CRISPR/Cas9在水产养殖中的应用涉及几个步骤。首先,设计特定的gRNA以匹配目标基因序列。然后,Cas9蛋白与目标DNA结合,造成双链断裂。最后,断裂被修复。 图片来源:https://doi.org/10.3390/ijms25179299
2011年
黄颡鱼
中国水产科学研究院珠江水产研究所、南京大学团队开展了黄颡鱼基因编辑研究,并于2014年通过敲除肌肉抑制基因,成功培育出生长快、肉质高、规格大的新品系黄颡鱼。
2013年
罗非鱼
西南大学王德寿团队通过基因编辑大规模开展罗非鱼新种质创制,实现对性别、体色、生长等性状的控制,使罗非鱼成为唯一规模化开展基因编辑的养殖鱼类。
2014年
半滑舌鳎
中国工程院院士陈松林团队首次对半滑舌鳎开展基因编辑研究并获成功,开海水养殖鱼类基因编辑之先河,由此推动了我国在各种海水养殖鱼类中开展此类研究。
随后,我国基因编辑技术研究进展加快,在团头鲂、异育银鲫、泥鳅、黄河鲤等品种上接连取得成果,通过编辑和生长相关的基因,进一步加快养殖生长速度,提高养殖效益。
同时,育种工作者对鲫鱼、半滑舌鳎、南方鲇、黄鳝等品种的性别基因研究,利用基因编辑技术进行性别鉴别、调控,突破了传统育种方式难以实现的领域,为加快创制适应未来的新品种提供了有力支持。

2022年1月,半滑舌鳎基因编辑快速生长雄鱼通过现场验收。 图片来源:中国水产研究科学院官网
自2021年起,中国水产科学研究院黑龙江水产研究所、华中农业大学等单位利用基因编辑技术消除鲤科鱼类肌间刺,成功获得“无刺”鲫鱼、团头鲂、草鱼等新种质。
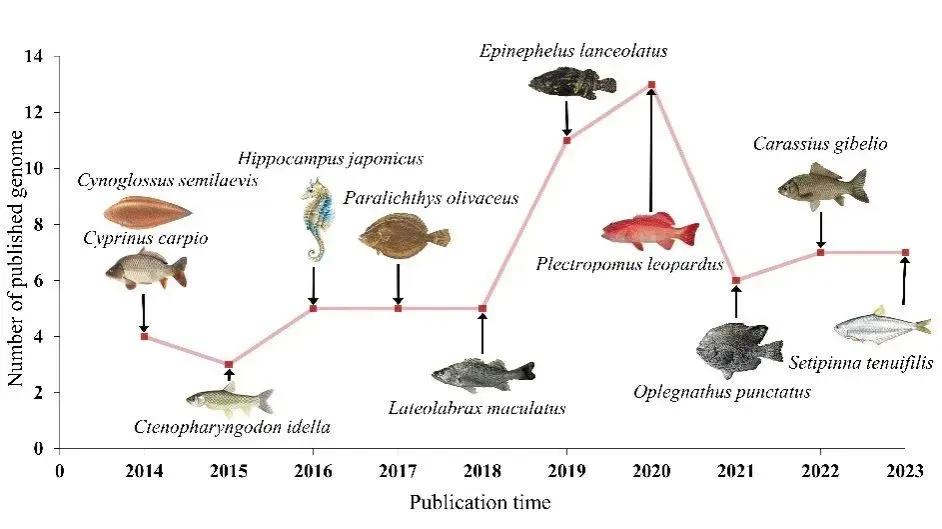
2014-2023年中国发表的鱼类基因论文数目(图中显示每年发表的代表性物种)。 来源:中国水产科学研究院黄海水产研究所官网
2025年,广东海大集团出资5000万元,与华中农业大学达成合作,独家获得“无肌间刺草鱼技术”使用期20年。
记者梳理资料发现,近十多年来,我国完成了50多种养殖鱼类全基因组测序和精细图谱绘制,发掘了海量基因资源。水产基因编辑研究领域涵盖品种之广,研究基因数量之多,均处于世界领先位置。

担忧
技术的潜在风险仍不可忽视
CRISPR技术的问世,极大推动了基因编辑的研究进程。
其中,CRISPR-Cas9系统因其操作简便、编辑效率高而被广泛应用。该系统原本是细菌抵御病毒的免疫机制,利用向导RNA引导核酸酶在基因组的特定位点进行切割,实现高精度的基因编辑。
然而,CRISPR虽已相对成熟,仍不可忽视其潜在风险。
中国科学院水生生物研究所研究员殷战团队在《鱼类基因编辑辅助育种的应用与生物安全风险管控》中总结,基因编辑生物的安全风险可归纳为三大核心——

①外源DNA的插入和留存:编辑过程中,外源DNA有可能被非预期地整合进宿主基因组。
例如在2019年,美国FDA检测美国Recombinetics公司基因编辑无角牛发现,在其基因编辑目标位点附近,含有一段外源细菌DNA序列的插入突变。2023年,巴西基因编辑“抗热短毛牛”初步获批商业化,但随后发现此技术可能导致牛皮肤疾病,项目因此搁浅。
②新蛋白毒性/致敏性:可能引入蛋白结构的新变化,需评估其是否对人体或动物具有潜在的毒性或致敏性。
该点特别提示食品安全风险,即基因编辑后的新品种作为食材或饲料,其新增蛋白质的生物活性、毒性、免疫原性等是否改变?目前国内外虽提出多种检验流程,但尚未形成统一标准。
③脱靶效应:可能在非目标位点引发突变,导致未曾预料的新编码蛋白产生,其安全效应未获充分测评。脱靶效应也是基因编辑工具应用中的核心生物安全风险。
此外,与植物作物相比,基因编辑动物应用还面临一些特定的环境和生态风险,尤其是水产养殖领域,开放的水域环境使潜在风险更为复杂。
例如:在养殖过程中,经过基因编辑的动物逃逸后,可能跟野生个体进行繁殖,导致其体内的人工基因进行遗传,如性别转换、肌间刺消除等,从而改变野生种群的性状分布和适应性,进而影响生态平衡。
部分学者进一步担忧,若基因编辑鱼逃逸并在野外建立繁殖群体,可能具备类入侵种属性,影响野生种群的生态功能,对种质资源,甚至水生态系统产生难以预期的风险。

曙光
科学家寻找技术与安全的平衡
面对以上众多问题,科学家也探索出了多层次的防控措施,试图在技术红利与安全保障间找到平衡。
严格的筛选和验证,是基因编辑生物安全风险的第一道关卡。
在技术开发阶段,科研人员会对经CRISPR编辑的生物进行全面的分子检测,包括全基因组测序、脱靶位点预测验证等。凡发现有非预期突变的个体,通常会被剔除或通过回交等方法去除不需要的变异。
例如,基因编辑猪的开发方在提交审批前,通过选择性繁育淘汰了所有非预期的基因组改动,只保留了预期的抗病突变。这种“过滤”过程确保最终用于应用的品系在基因层面尽可能纯净,仅携带目标编辑,从源头上降低了未知风险。
其次,不育是基因编辑商业化的先决条件。
2024年,美国水产养殖技术中心(Center for Aquaculture Technologies)首席执行官提出,经过不育处理的基因编辑鱼类,为政府监管提供了解决方案,并对保护环境健康有重要意义。
当前科研界普遍认同“可控不育”方向,即经过技术手段,消除养殖动物的生育能力,以保障野生种群的自然状态。近年来,刘少军院士、桂建芳院士团队等利用远缘杂交、多倍体诱导等技术,在鲫鱼、鲤鱼等品种上实现“可控不育”。
在水产养殖中,陆基封闭式设施(如循环水养殖系统)可大幅降低逃逸风险。
参考全球首个获批的转基因三文鱼案例,其采用陆地封闭养殖+三倍体不育雌鱼的双重隔离措施,降低环境扩散可能性。美国FDA也强调,对鱼类等高流动性动物需实施更严格的环境安全措施。
另外,撤销机制也可为已上市产品兜底。
今年3月,泰国出台基因编辑水生动物认证法规,明确若发现基因编辑品种出现非预期性状表达、养殖环境风险超标等情况,将撤销认证。
我国在分子标记辅助育种、全基因组选育等领域已取得快速进展,随着三倍体不育技术成熟、多维度评估体系完善、政策逐步松绑,基因编辑动物产业化的曙光正悄然显现。
2023年,中国科学院水生生物研究所首次对CRISPR/Cas9技术培育的养殖鱼类进行了食品安全性评估。研究团队按照评估含转基因成分食品健康风险的标准化方法,用含有基因编辑鲤鱼的饲料投喂实验动物,结果证实,实验组和正常喂养的对照组各方面均无显著差异。该研究为基因组编辑动物的渔业应用提供了重要科学依据。
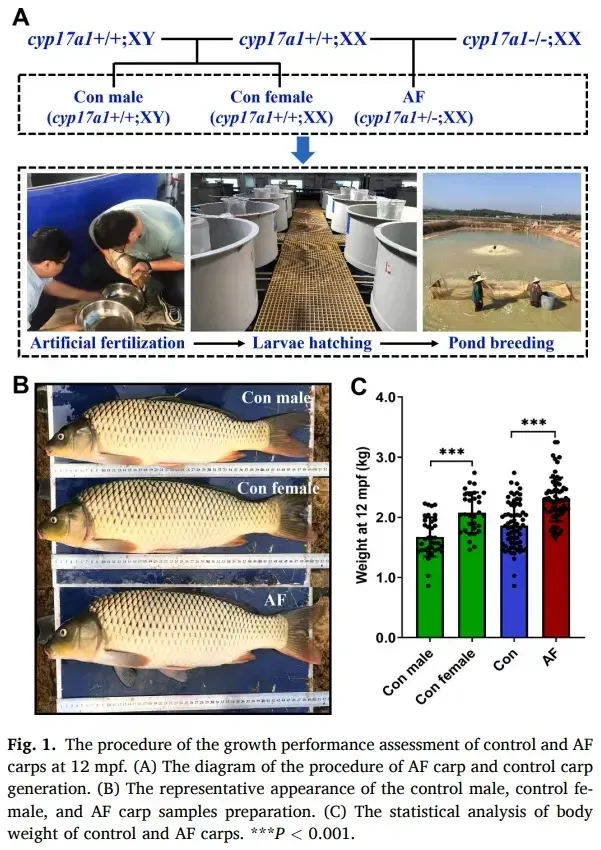
中国科学院水生生物研究所首次对CRISPR/Cas9技术培育的养殖鱼类进行了食品安全性评估。
长期关注罗非鱼基因编辑、分子标记等技术的王德寿教授认为,基因编辑技术已成为国际农业育种新的趋势,我国应建立一套严格的审核体系,验证基因编辑技术的安全性,对基因编辑水产品种谨慎地、可控地逐步放开。
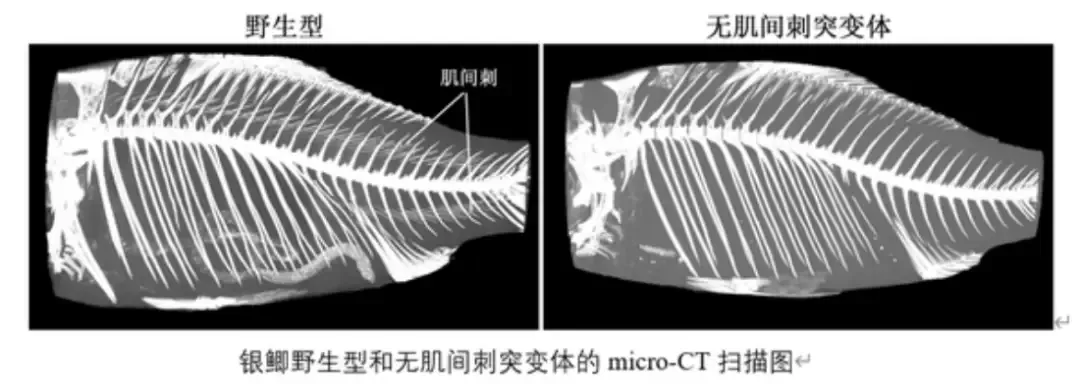
或许在不久的将来,“无肌间刺的草鱼”“抗病的罗非鱼”将不再是科研论文里的概念,而成为百姓餐桌上的日常——前提是,我们能以科学为基、以透明为桥,跨过安全评估与公众信任这两座大山。

采写:南方农村报记者 孙岁寒、李思敏
配资指数网官网,牛盘宝配资,开户配资炒股提示:文章来自网络,不代表本站观点。



